INFLIXIMAB: un viejo conocido… pero renovado
Revisión crítica del artículo: Schreiber S, wt al. Randomized Controlled Trial: Subcutaneous vs Intravenous Infliximab CT-P13 Maintenance in Inflammatory Bowel Disease. Gastroenterology. 2021 Jun;160(7):2340-2353.
doi: 10.1053/j.gastro.2021.02.068. PMID: 33676969.
Autores de la revisión: Astrid Rausch1 e Ignacio Zubiaurre1.
Co-editores: Federico Cassella, Ramiro Gonzalez Sueyro Institución: Hospital Britanico de Buenos Aires1.
¿QUÉ SABEMOS HASTA EL MOMENTO DEL TEMA?
- La llegada del Infliximab revolucionó el tratamiento de las enfermedades inflamatorias intestinales (EII) en 2002. Su aplicación es endovenosa (EV) con infusiones cada 8 semanas como mantenimiento. Esto implica que el paciente deba concurrir a un centro de infusión para su tratamiento, requiere personal de enfermería entrenado y recursos edilicios especiales.
- En 2015 se aprueba el primer biosimilar de infliximab (CT-P13) con un costo reducido y ampliando el acceso al tratamiento de los pacientes con EII. El CT-P13 subcutáneo (SC) fue aprobado por la Agencia Europea de medicamentos (EMA) para todas sus indicaciones, pero aún no se encuentra comercializado en Argentina1.
RESUMEN
Objetivo: Demostrar la no-inferioridad de los niveles séricos en valle de CT-P13 administrado en forma SC en comparación con la administración EV en semana 22 (S22) de tratamiento luego de inducción EV habitual.
Pregunta PICO: Población: Pacientes con Colitis Ulcerosa (CU) y Enfermedad de Crohn (EC) con actividad moderada a severa que recibieron inducción EV con CT-P13.
Intervención: CT-P13 SC. Comparador: CT-P13 EV. Outcomes/desenlace: niveles séricos en valle de CT-P13 en S22.
Diseño: Estudio abierto, multicéntrico, aleatorizado y controlado de grupos paralelos, fase 1.
Lugar: 50 centros en 15 países entre marzo de 2018 y enero 2020.
Sujetos: Criterios de inclusión (se describen los mas relevantes): Hombres o mujeres de 18-75 años con diagnóstico de CU o EC activa, moderada a severa (Score de Mayo: 6-12; y sub-score endoscópico ≥2 para CU; CDAI: 220-450 y SES-CD ≥6 ó proteína C reactiva (PCR)>0,5mg/dl ó Calprotectina >100 mcg/g para EC), de ≥3 meses de evolución, refractarios a tratamiento convencional (corticoides, inmunomoduladores o 5-ASA). Criterios de Exclusión (se describen los mas relevantes): uso previo de biológicos; antecedente de enfermedades neoplásicas en los últimos 5 años; insuficiencia cardíaca congestiva; fístulas entero-vesicales, entero-retroperitoneales, entero-cutáneas, entero-vaginales en los últimos 6 meses.
Figura 1. Diseño del Estudio
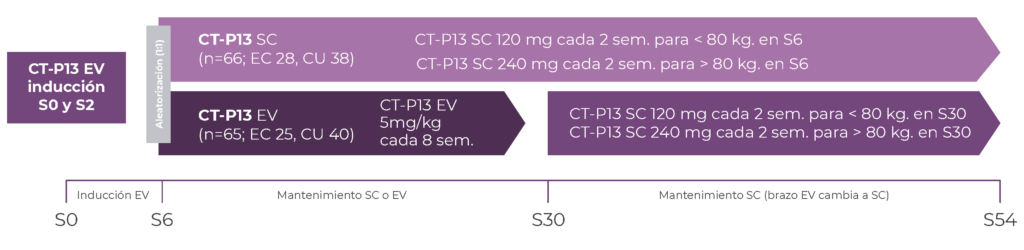
Aleatorización y asignación de la intervención: por bloques de número no revelado y estratificada (según uso previo de inmunomoduladores, respuesta clínica a la semana 6, actividad de la enfermedad, peso corporal y tipo de enfermedad); y asignación a través de una página web, en semana 6.
Intervención: CT-P13 120 mg SC en pacientes de menos de 80 kg de peso y 240 mg en pacientes de más de 80 kg de peso, cada 2 semanas a partir de inducción EV completa en S6.
Comparador: CT-P13 5 mg/kg EV cada 8 semanas a partir de S6.
Medidas de Resultados: Objetivo primario: La concentración sérica en valle de CT-P13 SC (no inferioridad) vs CT-P13 EV previo a la dosis de S22.
Objetivos secundarios: niveles séricos en valle objetivos de CT-P13 (>5 mcg/ml) previos a las aplicaciones (exploratorio), respuesta clínica, remisión clínica, respuesta endoscópica, remisión endoscópica, curación mucosa, calidad de vida (SIBDQ), tasa de eventos adversos e Inmunogenicidad (anticuerpos anti droga) en S30 y S54. Co-variables: edad, sexo, raza, etnia, altura, peso, IMC, tiempo al diagnóstico, PCR, calprotectina, tratamiento concomitante con inmunomoduladores/corticoides, respuesta clínica a la S6 (inducción completa), peso en S6 (≥80 o <80 kg).
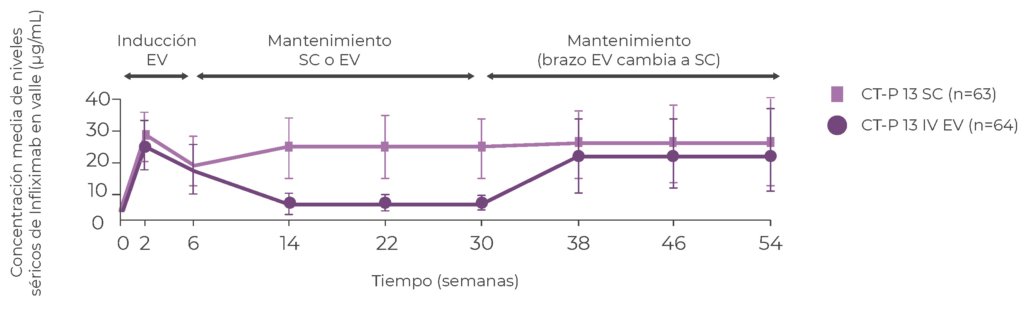
Cálculo de tamaño muestral: Para el objetivo primario se determinó un tamaño de muestra de 104 pacientes (52 por rama) para proporcionar un poder del 90% para demostrar la no inferioridad de CT-P13 SC frente a CT-P13 IV con intervalo de confianza unilateral del 95% para la relación media geométrica de mínimos cuadrados de niveles séricos en valle en S22. Se determinó un margen de no inferioridad del 80%, un nivel alfa unilateral del 5%, un índice esperado de 1.3 y un coeficiente de variación porcentual del 100%. Considerando una tasa de abandono del 20%, se estimó la necesidad de incluir 130 pacientes. Consideraciones éticas: Solicitud de consentimiento informado escrito, aprobación de comités de ética. Recogida de datos y análisis estadístico: Adecuadamente descriptos en el protocolo. Resultados: Se aleatorizaron 131 pacientes (66 rama SC y 65 en la rama EV). Las características basales en ambos grupos fueron similares. La media de niveles de droga en valle en S22 fue mayor en el grupo CT-P13 SC (21,45; DS:9,86 μg/mL) que en el grupo CT-P13 IV (2,93; DS:2,62 μg/mL). Mediante el análisis de covarianza, la razón de mínimos cuadrados geométricos (IC del 90%) fue 1154,17% (786,37-1694,00), observándose que el límite inferior del IC del 90% superó el 80% sobre la administración EV, cumpliendo así el resultado primario de no inferioridad de la forma SC. La media de niveles de droga en valle en S22 superó el objetivo terapéutico de 5 μg/mL para los pacientes que recibieron CT-P13 SC 120 o 240 mg, pero esto estuvo por debajo del umbral para los pacientes que recibieron CT-P13 IV.
Figura 2. Resultados (objetivo primario)
En los pacientes con CU, la tasa de respuesta clínica en S30 fue de 86,8% para CT-P13 SC y de 74,4% para CT-P13 EV (p=0,2501); y las tasas de remisión clínica 60,5% y 38,5% respectivamente (p= 0.0694). EL 47,4% de los pacientes en la rama CT-P13 SC y el 30,8% en CT-P13 IV lograron la curación mucosa (p = 0,1646). En los pacientes con EC, la tasa de respuesta clínica en S30 fue de 67,8% para CT-p13 SC y de 64% para CT-P13 EV (p=ns); y las tasas de remisión clínica 64,3% y 56% respectivamente (p= ns). La proporción de pacientes que lograron respuesta endoscópica en la S22 fue de 78,6% para CR-P13 SC vs 42,9% para EV ; y de remisión endoscópica 35,7% vs 14,3% respectivamente (p= 0 .6126). Se observaron niveles similares de mejora en las puntuaciones medias en el SIBDQ en ambos brazos en S30. En S22, 31,8% de los pacientes en rama SC desarrollaron anticuerpos anti droga (AAD) y 49,2% en la rama EV (p=0,0510). Hasta S30, 57.6% y 49.2% de los pacientes presentaron eventos adversos (EA) en la rama CT-P13 SC y CT-P13 EV respectivamente (p= 0,3833); y los EA relacionados con el fármaco fueron de 33,3% para la rama SC y 23,1% para la rama EV (p = 0,2448). Sólo 3,0% y 6,2% pacientes en las ramas CT-P13 SC y CT-P13 EV presentaron EA graves (p= 0,4403). El 4,6% de los pacientes en el grupo CT-P13 IV informaron eventos adversos que llevaron a la interrupción del fármaco del estudio. No se informaron muertes durante el estudio.
FORTALEZAS
- Estudio multicéntrico.
- Estudio aleatorizado y controlado.
- Los resultados endoscópicos tuvieron lectura central.
- Desenlace primario objetivo con poco riesgo de sesgo a pesar de no ser un estudio ciego.
LIMITACIONES
- Al ser un estudio abierto, podrían sufrir sesgos los resultados en los desenlaces clínicos.
- Número pequeño de pacientes para lograr resultados concluyentes en los objetivos secundarios clínicos y de inmunogenicidad (bajo poder).
NIVEL DE EVIDENCIA /CALIDAD DEL REPORTE
El estudio cumple con 20 de los 22 items propuesto por la guías CONSORT2 para ensayo clínicos de no inferioridad. El estudio aporta un nivel de Evidencia 1b (Centro de MBE de Oxford3).
¿QUÉ CONOCIMIENTO NUEVO APORTA?
- Luego de una inducción endovenosa en semana 0 y 2, la aplicación de infliximab subcutáneo en el mantenimiento de pacientes con CU y EC moderada a severa naïve de biológicos, mantuvo niveles séricos de droga comparables a su aplicación endovenosa.
- La seguridad y eficacia fueron comparables entre ambos grupos, aunque el estudio probablemente no tenga poder suficiente para hallar diferencias en estos desenlaces.
REFERENCIAS
(1) European Medicines Agency. Extension of indication variation assessment report: Remsima. Available at: https://www.ema.europa.eu/en/documents/variation- report/remsima-h-c-2576-ii-0082-epar-assessment-eport-variation_en.pdf; 2020. Accessed February 17, 2021; 2020.
(2) Piaggio, Gilda et al. “Reporting of noninferiority and equivalence randomized trials: an extension of the CONSORT statement.” JAMA vol. 295,10 (2006): 1152-60. doi:10.1001/jama.295.10.1152.
(3) Centre for Evidence-based Medicine (CEBM)-Levels of Evidence (March 2009). Disponible en https://www.cebm.ox.ac.uk/resources/levels-of-evidence/o xford-centre-for-evidence-based-medicine-levels-of-evide nce-march-2009
MINI-BIO DE AUTORES

Ignacio Zubiaurre. Médico gastroenterólogo. Jefe de Servicio de Gastroenterología y miembro de la Unidad Multidisciplinaria de Enfermedades Inflamatorias Intestinales del Hospital Británico de Buenos Aires. Ex-secretario y actual miembro de GADECCU.

Astrid Rausch. Médica gastroenteróloga. Miembro de la Unidad Multidisciplinaria de Enfermedades Inflamatorias Intestinales del Hospital Británico de Buenos Aires. Miembro de la subcomisión de Comunicación de GADECCU. Co-coordinadora de Proyecto Echo EII Argentina.

